開発パイプライン

当社は、
社会的負託に応える形で、
顧みられない医薬品の開発に真正面から
取り組んできました。
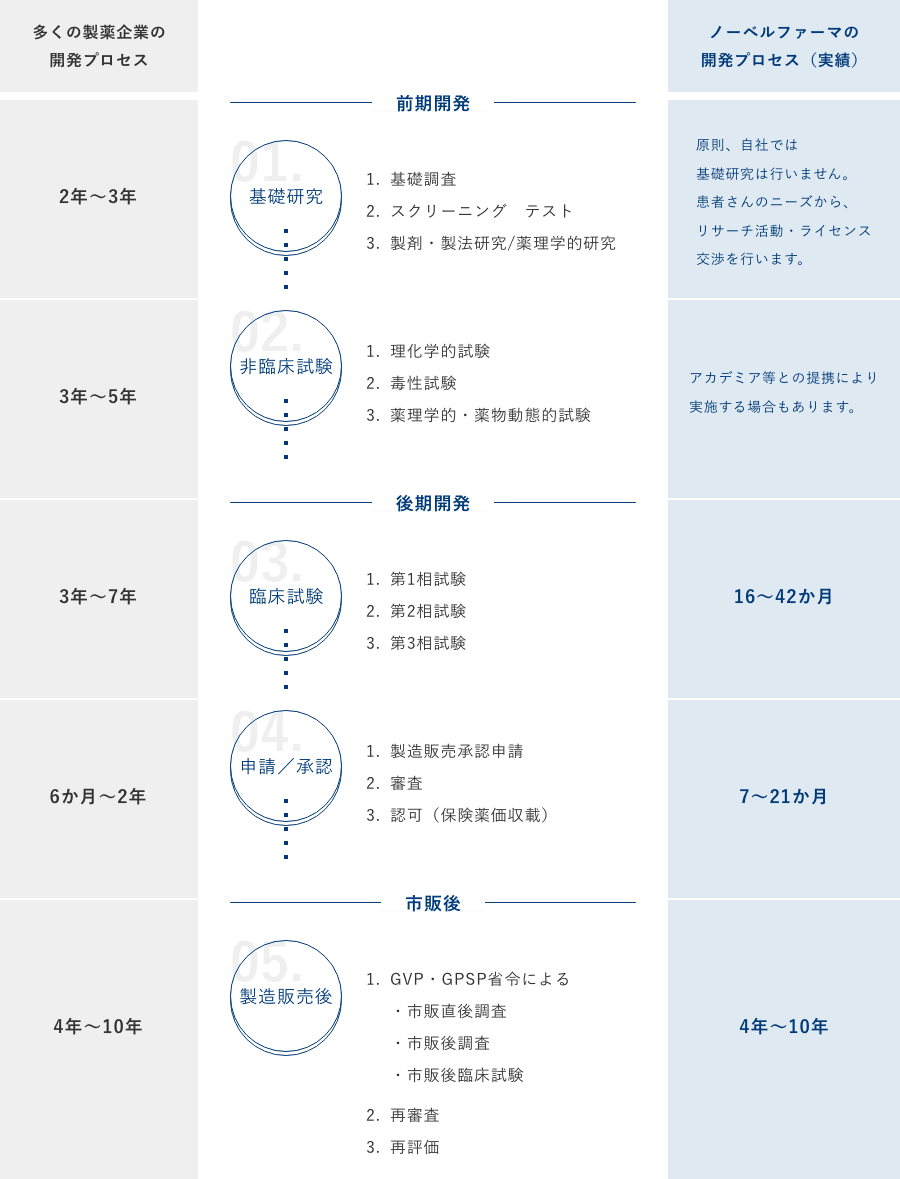
当社は、多くの製薬会社が、患者さんが少ないために収益を見込むことができず、積極的に開発を手がけてこなかった医薬品(=アンメットニーズ医薬品)の研究開発を常に目指してきました。開発パイプラインの中心は、学会や患者さん、あるいは行政からの強い開発の要請を受けたオーファンドラッグ(希少疾病用医薬品)、適応外で使用されている医薬品、小児用医薬品などです。少数精鋭体制で効率の良い研究開発を行うことにより、市場規模の比較的小さな医薬品の承認取得を可能にしています。
このように、これまで欧⽶ではすでに販売され、わが国でも⾼いニーズがあるにもかかわらず、⽇本国内では開発されてこなかった「未承認薬」を多く⼿がけてきましたが、今後は新しい概念の治療薬にもチャレンジしていきます。
ノーベルファーマの
開発プロセス
今後の開発計画
パイプラインは、開発中の未承認薬または未承認適応の開発状況を示しておりますので、医薬品の宣伝や広告を目的とするものではありません。
- 注:効能・効果、承認はあくまで予定です。
- 略号:米(米国)、欧(欧州)、中(中国)
A.新医薬品・新医療機器・再生医療等製品(Global同時開発品を含む)
2025年9月現在
| 品名 | 予定効能・効果 | 提携先 | 開発ステージ | 承認予測 | |
|---|---|---|---|---|---|
| 1 | NPC-30 (GAIA-102) 高活性NK様細胞 |
神経芽腫 | ガイアバイオメディシン社 九州大学 |
PI | 2026年12月 |
| 2 | NPC-22 スコポラミン貼付剤 |
慢性流涎症 | 自社医薬品 | PII/III | 2027年3月 |
| 3 | NPC-33 ナキシタマブ |
神経芽腫 | Y-mAbs Therapeutics社 |
PI | 2027年3月 |
| 4 | NPC-29 ユビキノール |
多系統萎縮症 | 東京大学 | PIII準備中 | 2029年8月 |
| 5 | NPC-31 P092マレイン酸塩 |
プリオン病 | 岐阜大学 | PI/II準備中 | 未定 |
| 6 | NPC-32 血小板凝集促進剤 |
心臓血管外科、救急領域 | 防衛医科大学校 早稲田大学 |
前臨床 | 未定 |
| 7 | MD-02 | 耳鼻咽喉科向け レーザーシステム |
A.R.C. Laser Gmbh. | 申請準備中 | 未定 |
B.ライフ・サイクル・マネジメント(LCM)品(Global同時開発品を含む)
2025年9月現在
| 品名 | 予定効能・効果 | 提携先 | 開発ステージ | 承認予測 | |
|---|---|---|---|---|---|
| 1 | NPC-12 ラパリムス |
限局性皮質異形成II型てんかん発作 (新効能) |
昭和大学 | PIII | 2026年9月 |
| 2 | NPC-12 ラパリムス |
原発性免疫不全症候群 (新効能) |
東京科学大学 防衛医科大学校 |
PII | 2026年9月 |
| 3 | NPC-18 リティンパ |
外耳道軟部組織欠損 (新効能) |
科研製薬 | PIII | 2026年9月 |
| 4 | NPC-25 ジンタス |
低亜鉛血症 (新剤型・小児用量追加) |
自社開発品 | PIII | 2027年9月 |
| 5 | NPC-12 ラパリムス |
赤芽球癆 (新効能) |
信州大学 | PII | 2028年1月 |
| 6 | NPC-06 ホストイン |
三叉神経痛 (新効能) |
Pfizer社 | PIII | 2028年9月 |
| 7 | NPC-12 ラパリムス |
Pendred症候群 (新効能) |
慶應義塾大学 北里大学 |
PII | 未定 |
| 8 | NPC-12 ラパリムス |
全身性強皮症 (新効能) |
大分大学 | PI/II | 未定 |
| 9 | NPC-12G ラパリムスゲル |
脈管異常による 皮膚病変(新効能) |
和歌山医科大学 | PII/III準備中 | 未定 |
| 10 | NPC-15 メラトベル |
軽度認知障害、認知症軽度の入眠困難 (新効能) |
自社開発品 | PII | 未定 |
| 11 | NPC-26 サルグラモスチム |
肺非結核性抗酸菌症 (新効能) |
新潟大学 | PII | 未定 |
C.海外開発品
2025年9月現在
| 品名 | 予定効能・効果 | 提携先 | 開発ステージ | 承認予測 | ||
|---|---|---|---|---|---|---|
| 1 | NPC-15 (メラトベル) |
小児期の神経発達症に 伴う入眠困難の改善 |
- | 中国 | 申請中 | 2025年8月 |
| 2 | NPC-02 (ノベルジン) |
低亜鉛血症 (新効能) |
- | 中国 | 申請 準備中 |
2026年4月 |
